แบบจำลองอะตอมของจอร์น ดอลตัน

ในปี พ.ศ. 2346 (ค.ศ. 1803) จอห์น ดอลตัน (John Dalton) นักวิทยาศาสตร์ชาวอังกฤษได้เสนอทฤษฎีอะตอม
เพื่อใช้อธิบายเกี่ยวกับการเปลี่ยนแปลงของสารก่อนและหลังทำปฏิกิริยา รวมทั้งอัตราส่วนโดยมวลของธาตุที่รวมกันเป็นสารประกอบ ซึ่งสรุปได้ดังนี้
1. ธาตุประกอบด้วยอนุภาคเล็กๆหลายอนุภาคเรียกอนุภาคเหล่านี้ว่า “อะตอม” ซึ่งแบ่งแยกและทำให้สูญหายไม่ได้
2. อะตอมของธาตุชนิดเดียวกันมีสมบัติเหมือนกัน แต่จะมีสมบัติ แตกต่างจากอะตอมของธาตุอื่น
3. สารประกอบเกิดจากอะตอมของธาตุมากกว่าหนึ่งชนิดทำปฏิกิริยา เคมีกันในอัตราส่วนที่เป็นเลขลงตัวน้อยๆ
จอห์น ดอลตัน ชาวอังกฤษ เสนอทฤษฎีอะตอมของดอลตัน
- อะตอมเป็นอนุภาคที่เล็กที่สุด แบ่งแยกอีกไม่ได้
- อะตอมของธาตุชนิดเดียวกันมีสมบัติเหมือนกัน
- อะตอมต้องเกิดจากสารประกอบเกิดจากอะตอมของธาตุตั้งแต่ 2 ชนิดขึ้นไปมารวมตัวกันทางเคมี
ทฤษฎีอะตอมของดอลตันใช้อธิบายลักษณะและสมบัติของอะตอมได้เพียงระดับหนึ่ง แต่ต่อมานักวิทยาศาสตร์ค้นพบข้อมูลบางประการที่ไม่สอดคล้องกับทฤษฎีอะตอมของ ดอลตัน เช่น พบว่าอะตอมของธาตุชนิดเดียวกันอาจมีมวลแตกต่างกันได้
ลักษณะแบบจำลองอะตอมของดอลตัน

ทรงกลมตันมีขนาดเล็กที่สุดซึ้งแบ่งแยกอีกไม่ได้
แบบจำลองอะตอมของทอมสัน
เซอร์โจเซฟ จอห์น ทอมสัน นักวิทยาศาสตร์ชาวอังกฤษ ได้ทำการศึกษาและทดลองเกี่ยวกับการนำไฟฟ้าของก๊าซโดยใช้หลอดรังสีแคโทด

หลอดรังสีแคโทด
เป็นเครื่องที่ใช่ทดลองเกี่ยวกับการนำไฟฟ้าโดยหลอดรังสีแคโทดจะมีความดันต่ำมาก และความต่างศักย์สูงมาก วิลเลียม ครูกส์ได้สร้างหลอดรังสีแคโทดขึ้นมาโดยใช้แผ่นโลหะ 2 แผ่นเป็นขั้วไฟฟ้า โดยต่อขั้วไฟฟ้าลบกับขั้วลบของเครื่องกำเนิดไฟฟ้าเรียกว่า แคโทด และต่อขั้วไฟฟ้าบวกเข้ากับขั้วบวกของเครื่องกำเนิดไฟฟ้าเรียกว่า แอโนด

การค้นพบอิเล็กตรอน
เซอร์โจเซฟ จอห์น ทอมสัน ดัดแปลงหลอดรังสีใหม่ ดังรูป

รังสีพุ่งจากด้าแคโทดไปยังด้านแอโนด และจะมีรังสีส่วนหนึ่งทะลุออกไปกระทบกับฉากเรืองแสง
หลังจากนั้นทอมสันได้เพิ่มขั้วไฟฟ้าเข้าไปในหลอดรังสีแคโทดดังรูป

ปรากฎว่า รังสีนี้จะเบี่ยงเบนเข้าหาขั้วบวก แสดงว่า รังสีนี้ต้องเป็นประจุลบ แต่ไม่ทราบว่าเกิดจากก๊าซในหลอดรังสีแคโทด หรือเกิดจากขั้วไฟฟ้าทอมสันจึงทำการทดลองเกี่ยวกับการนำไฟฟ้าของก๊าซในหลอดรังสีแคโทด พบว่า ไม่ว่าจะใช้ก๊าซใดบรรจุในหลอดหรือใช้โลหะใดเป็นแคโทด จะได้ผลการทดลองเหมือนเดิม จึงสรุปได้ว่า อะตอมทุกชนิดมีอนุภาคที่มีประจุลบเป็นองค์ประกอบ เรียกว่า "อิเล็กตรอน"
การค้นพบโปรตอน
เนื่องจากอะตอมเป็นกลางทางไฟฟ้า และการที่พบว่าอะตอมของธาตุทุกชนิดประกอบด้วยอิเล็กตรอนซึ่งมีประจุไฟฟ้าเป็นลบ ทำให้นักวิทยาศาสตร์เชื่อว่าองค์ประกอบอีกส่วนหนึ่งของอะตอม จะต้องมีประจุบวกด้วย ออยแกน โกลด์สไตน์ (Eugen Goldstein) นักวิทยาศาสตร์ชาวเยอรมัน ได้ทดลองเกี่ยวกับหลอดรังสีแคโทด โดยดัดแปลงหลอดรังสีแคโทด ดังรูป


สรุปแบบจำลองของทอมสัน
จากผลการทดลอง ทั้งของทอมสันและโกลด์สไตน์ ทำให้ทอมสันได้ข้อมูลเกี่ยวกับอะตอมมากขึ้น จึงได้เสนอแบบจำลองอะตอม ดังนี้ อะตอมมีลักษณะเป็นทรงกลมประกอบด้วยอนุภาคโปรตอนที่มีประจุไฟฟ้าเป็นบวกและอนุภาคอิเล็กตรอนที่มีประจุไฟฟ้าเป็นลบ กระจัดกระจายอย่างสม่ำเสมอในอะตอมอะตอมที่มีสภาพเป็นกลางทางไฟฟ้าจะมีจำนวนประจุบวกเท่ากับจำนวนประจุลบ

แบบจำลองอะตอมของรัทเทอร์ฟอร์ด
ลอร์ดเออร์เนสต์ รัทเทอร์ฟอร์ด ได้ทำการทดลอง โดยการยิงอนุภาคแอลฟาไปยังแผ่นทองคำดังรูป



ผลการทดลอง สรุปได้ดังนี้
• จุด X เป็นจุดที่อนุภาคแอลฟาผ่านไปยังฉากในแนวเส้นตรง แสดงว่า ภายในอะตอมน่าจะมีพื้นที่ว่างเป็นจำนวนมาก เพราะ อนุภาคแอลฟาส่วนใหญ่ทะลุผ่านแผนทองคำเป็นแนวเส้นตร ง

• จุด Y อนุภาคแอลฟาเบี่ยงเบนเล็กน้อย แสดงว่าภายในอะตอมควรมีอนุภาคบางอย่างรวมกันเป็นกลุ่มก้อนขนาดเล็ก มีมวลมากพอที่ทำให้อนุภาคแอลฟาวิ่งไปเฉียดแล้วเบี่ยงเบน

• จุด Z อนุภาคแอลฟาสะท้อนกลับ แสดงว่าในอะตอมจะมีอนุภาคบางอย่างที่เป็นกลุ่มก้อน มีทวลมากพอที่ทำให้อนุภาคแอลฟาสะท้อนกลับ

การค้นพบนิวตรอน
สาเหตุที่ค้นพบนิวตรอน
1. เนื่อจากมวลของอะตอมต่าง มักเป็น 2 เท่า หรือมากกว่า 2 เท่าของมวลโปรตรอนรวมรัทเทอร์ฟอร์ดสันนิษฐานว่า น่าจะมีอนุภาคอีกชนิดหนึ่งอยู่ในนิวเคลียส และอนุภาคนี้ต้องมีมวลใกล้เคียงกันกับมวลของโปรตรอนมาก และต้องเป็นกลางทางไฟฟ้า
2. ทอมสันศึกษาหามวลของอนุภาคบวกของ Ne ปรากฎว่า อนุภาคบวกนี้มีมวล 2 เท่า ผลการทดลองนี้สนับสนุนว่าจะต้องมีอนุภาคอีกชนิดหนึ่งอยู่ในนิวเคลียสเชดวิก ได้ยิงอนุภาคแอลฟาไปยัง Be ปรากฎว่าได้อนุภาคชนิดนึ่งออกมาซึ่งมีมวลใกล้เคียงกับมวลของโปรตรอนและไม่มีประจุไฟฟ้า เรียกอนุภาคนี้ว่า "นิวตรอน"

สรุปแบบจำลองอะตอมของรัทเทอร์ฟอร์ด
อะตอมประกอบด้วยนิวเคลียสที่มีโปรตอนรวมกันอยู่ตรงกลาง นิวเคลียสมีขนาดเล็ก แต่มีมวลมากและมีประจุเป็นบวก ส่วนอิเล็กตรอนซึ่งมีประจุเป็นลบ และมีมวลน้อยมาก จะวิ่งอยู่รอบนิวเคลียสเป็นบริเวณกว้าง

เเบบจำลองของโบร์
นักวิทยาศาสตร์ได้พยายามศึกษาลักษณะของการจัดอิเล็กตรอนรอบๆ อะตอม โดยแบ่งการศึกษาออกเป็น 2 ส่วน ส่วนแรกเป็นการศึกษษเกี่ยวกับสเปกตรัมของอะตอม ซึ่งทำให้ทราบว่าภายในอะตอมมีการจัดระดับพลังงานเป็นชั้นๆ ในแต่ละชั้นจะมีอิเล็กตรอนบรรจุอยู่ ส่วนที่สองเป็นการศึกษาเกี่ยวกับพลังงานไอโอไนเซชัน เพื่อดูว่าในแต่ละระดับพลังงานจะมีอิเล็กตรอนบรรจุอยู่ได้กี่ตัว
นีลส์โบร์ ได้เสนอแบบจำลองอะตอมขึ้นมา สรุปได้ดังนี้
1 . อิเล็กตรอนจะเคลื่อนที่รอบนิวเคลียสเป็นชั้นๆ ตามระดับพลังงาน และแต่ละชั้นจะมีพลังงานเป็นค่าเฉพาะตัว
2. อิเล็กตรอนที่อยู่ใกล้นิวเคลียสมากที่สุดจะเรียกว่าระดับพลังงานต่ำสุดยิ่งอยู่ห่างจากนิวเคลียสมากขึ้น ระดับพลังงานจะยิ่งสูงขึ้น
3. อิเล็กตรอนที่อยู่ใกล้นิวเคลียสมากที่สุดจะเรียกระดับพลังงาน n = 1 ระดับพลังงานถัดไปเรียกระดับพลังงาน n =2, n = 3,… ตามลำดับ หรือเรียกเป็นชั้น K , L , M , N ,O , P , Q ….
1 . อิเล็กตรอนจะเคลื่อนที่รอบนิวเคลียสเป็นชั้นๆ ตามระดับพลังงาน และแต่ละชั้นจะมีพลังงานเป็นค่าเฉพาะตัว
2. อิเล็กตรอนที่อยู่ใกล้นิวเคลียสมากที่สุดจะเรียกว่าระดับพลังงานต่ำสุดยิ่งอยู่ห่างจากนิวเคลียสมากขึ้น ระดับพลังงานจะยิ่งสูงขึ้น
3. อิเล็กตรอนที่อยู่ใกล้นิวเคลียสมากที่สุดจะเรียกระดับพลังงาน n = 1 ระดับพลังงานถัดไปเรียกระดับพลังงาน n =2, n = 3,… ตามลำดับ หรือเรียกเป็นชั้น K , L , M , N ,O , P , Q ….
เเบบจำลองของกลุ่มหมอก
เนื่องจากแบบจำลองอะตอมของโบร์ ใช้อธิบายเกี่ยวกับเส้นสเปกตรัมของธาตุไฮโดรเจนได้ดี แต่ไม่สามารถอธิบายเส้นสเปกตรัมของอะตอมที่มีหลายอิเล็กตรอนได้ จึงได้มีการศึกษาเพิ่มเติมทาง กลศาสตร์ควอนตัม แล้วสร้างสมการสำหรับใช้คำนวณโอกาสที่จะพบอิเล็กตรอนในระดับพลังงานต่างๆ ขึ้นมาจนได้แบบจำลองใหม่
สเปกตรัม
สเปกตรัม หมายถึง อนุกรมของแถบสีหรือ หรือเส้นที่ได้จากการผ่านพลังงานรังสีเข้าไปในสเปกโตรสโคป ซึ่งทำให้พลังงานรังสีแยกออกเป็นแถบหรือเป็นเส้นที่มีความยาวคลื่นต่าง ๆ เรียงลำดับกันไป
สเปกตรัมของอะตอม (atomic spectrum)
คลื่นแม่เหล็กไฟฟ้าในช่วงแสงขาวประกอบด้วยแสงที่มีความยาวคลื่นหลายค่าซึ่งเราไม่สามารถแยกส่วนประกอบของคลื่นต่าง ๆ ออกจากกันด้วยตาได้ ต้องใช้เครื่องมือช่วย เช่น ปริซึม หรือสเปกโตรสโคป (spectroscope) เมื่อเราผ่านแสงสีขาวหรือแสงสีต่าง ๆ ไปยังปริซึม แสงจะแยกออกมาเป็นแถบสีต่าง ๆ เรียงกันตามความยาวคลื่น แถบสีที่แยกออกมาได้เรียกว่า สเปกตรัม
แบ่งเป็น 2 ประเภท ดังนี้
1. สเปกตรัมแบบต่อเนื่อง (continuous spectrum) จะเป็นสเปกตรัมที่ประกอบด้วยแสงที่มีความยาวคลื่นและความถี่ต่อเนื่องจนเห็นเป็นแถบ ได้แก่ สเปกตรัมของแสงขาวซึ่งจะเห็นเป็นแถบสีรุ้งเรียงต่อกัน โดยแสงสีม่วงหักเหมากที่สุด มีความยาวคลื่นสั้น แต่มีพลังงานมากที่สุด ในขณะที่แสงสีแดงจะหักเหน้อยที่สุด มีความยาวคลื่นยาวที่สุด และมีพลังงานน้อยที่สุด
2. สเปกตรัมแบบไม่ต่อเนื่องหรือแบบเส้น (Discontinuous spectrum or Line spectrum) เป็นสเปกตรัมที่ประกอบด้วยเส้นสเปกตรัมที่มีความยาวคลื่นบางค่าเว้นระยะเป็นเส้น ๆ บนพื้นดำ เนื่องจากสเปกตรัมแต่ละเส้นเป็นคลื่นแม่เหล็กไฟฟ้า เราจึงสามารถคำนวณหาค่าพลังงานของเส้นสเปกตรัมแต่ละเส้นได้จากสมการ
ความยาวคลื่น (Wavelength) l ( แลมบ์ดา ) หมายถึง ระยะทางที่คลื่นเคลื่อนที่ครบ 1 รอบพอดี มีหน่วยเป็นเมตร ( m )
หรือหน่วยย่อยของเมตร เช่น นาโนเมตร (nm) โดย 1 nm = 10-9 เมตร

ความถี่ของคลื่น n (นิว) หมายถึง จำนวนรอบของคลื่นที่เคลื่อนที่ผ่านจุดใดจุดหนึ่งในเวลา 1 วินาที
มีหน่วยเป็นจำนวนรอบต่อวินาที หรือ เฮิร์ตซ์ (Hertz) หรือ Hz
แอมปลิจูด (Amplitude) คือ ความสูงของยอดคลื่น
คลื่นที่จะศึกษากันในที่นี้เป็นคลื่นแม่เหล็กไฟฟ้าในช่วงความยาวคลื่นระหว่าง 380 ถึง 750 nmซึ่งเป็นช่วงคลื่นที่มีความยาวและความถี่ที่ประสาทตาของคนจะรับได้ เรียกคลื่นแม่เหล็กไฟฟ้าช่วงดังกล่าวนี้ว่า “แสงขาว (Visibel light)”
ดูตัวอย่างการคำนวณความยาวคลื่น ความถี่และพลังงาน

สเปกตรัมเกิดได้อย่างไร
สถานะพื้น (ground state)
หมายถึงอะตอมที่อิเล็กตรอนซึ่งเคลื่อนที่อยู่รอบนิวเคลียสมีพลังงานเฉพาะตัวอยู่ในระดับพลังงานต่ำ อะตอมในสถานะพื้นจะมีความเสถียรเนื่องจากมีพลังงานต่ำ
สถานะกระตุ้น (excited state)
หมายถึงอะตอมที่ได้รับพลังงานเพิ่มขึ้น ทำให้อิเล็กตรอนถูกกระตุ้นให้อยู่ในระดับพลังงานสูงขึ้น ที่สถานะกระตุ้นอะตอมจะไม่เสถียร เนื่องจากมีพลังงานสูง

อะตอมที่ได้รับพลังงาน เช่น จากการเผา หรือจากกระแสไฟฟ้า อิเล็กตรอนจะเปลี่ยนจากสถานะพื้นไปสู่สถานะกระตุ้นซึ่งไม่เสถียร จึงต้องคายพลังงานออกมา ซึ่งพลังงานที่คายออกมาจะอยู่ในรูปพลังงานแสงหรือคลื่นแม่เหล็กไฟฟ้า เมื่อผ่านปริซึมหรือสเปกโตรสโคปจะแยกแสงออกเป็นเส้นสเปกตรัม
การที่ธาตุแต่ละชนิดให้เส้นสเปกตรัมออกมาหลายเส้น แสดงว่าอิเล็กตรอนที่อยู่รอบนิวเคลียสมีหลายระดับพลังงาน ระดับพลังงานที่อยู่ใกล้นิวเคลียสจะมีพลังงานต่ำ ส่วนระดับพลังงานที่อยู่ห่างนิวเคลียสจะมีพลังงานสูง เมื่ออิเล็กตรอนคายพลังงานอาจคายพลังงานได้หลายช่วงความยาวคลื่น จึงมองเห็นเส้นสเปกตรัมได้หลายเส้น
นักวิทยาศาสตร์ได้ศึกษาสเปกตรัมของแก๊ส เพราะว่ามีอะตอมอยู่ห่างกัน และใช้อะตอมไฮโดรเจนเนื่องจากมี 1 อิเล็กตรอน พบว่ามีเส้นสเปกตรัมที่ปรากฏในช่วงความยาวคลื่นที่มองเห็นได้โดยมีความยาวคลื่น 410 , 434 , 486 และ 656 นาโนเมตร ตามลำดับ นอกจากนี้การศึกษาเส้นสเปกตรัมของอะตอมของธาตุอื่นๆ ก็พบว่าอิเล็กตรอนในอะตอมของแต่ละธาตุคายพลังงานได้บางค่า และมีเส้นสเปกตรัมเฉพาะตัวไม่ซ้ำกัน โดยเส้นสีแดงมีพลังงานต่ำสุด (3.02 x 10–22 kJ) และเส้นสีม่วงมีพลังงานสูงสุด (4.48 x 10–22 kJ)



การที่นักวิทยาศาสตร์ใช้อะตอมของไฮโดรเจนเป็นตัวอย่างในการแปลความหมายของเส้นสเปกตรัม เพราะเป็นอะตอมที่มีอิเล็กตรอนเดียว จากการทดลองหลายครั้งพบว่าอะตอมของไฮโดรเจนให้เส้นสเปกตรัมได้หลายเส้นที่มีลักษณะเหมือนกันทุกครั้ง จึงสรุปได้ว่าอิเล็กตรอนในอะตอมของไฮโดรเจนขึ้นไปอยู่ในสถานะกระตุ้นที่มีพลังงานแตะต่างกันได้หลายระดับ ค่าพลังงานของเส้นสเปกตรัมแสดงให้เห็นถึงการเปลี่ยนระดับพลังงานของอิเล็กตรอนในอะตอมจากระดับพลังงานสูงมายังระดับพลังงานต่ำ


จากข้อมูลในตาราง แสดงว่าอะตอมของไฮโดรเจนมีพลังงานหลายระดับและความแตกต่างระหว่างพลังงานของแต่ละระดับที่อยู่ถัดไปก็ไม่เท่ากัน ความแตกต่างของพลังงานจะมีค่าน้อยลงเมื่อระดับพลังงานสูงขึ้น จากเหตุผลที่อธิบายมานี้ช่วยให้สรุปได้ว่า
1. เมื่ออิเล็กตรอนได้รับพลังงานในปริมาณที่เหมาะสม อิเล็กตรอนจะขึ้นไปอยู่ในระดับพลังงานที่สูงกว่าระดับพลังงานเดิม แต่จะอยู่ในระดับใดขึ้นกับปริมาณพลังงานที่ได้รับ การที่อิเล็กตรอนขึ้นไปอยู่ในระดับพลังงานใหม่ทำให้อะตอมไม่เสถียร อิเล็กตรอนจะกลับมาอยู่ในระดับพลังงานที่ต่ำกว่า ซึ่งในการเปลี่ยนตำแหน่งนี้อิเล็กตรอนจะคายพลังงานออกมา การดูดหรือคายพลังงานจะต้องมีค่าเฉพาะตามทฤษฎีของพลังค์ โดยค่าต่ำสุดจะเท่ากับความถี่ของอิเล็กตรอนนั้นคูณด้วยค่าคงที่ของพลังค์
2. การเปลี่ยนระดับพลังงานของอิเล็กตรอนไม่จำเป็นต้องเปลี่ยนไปยังระดับพลังงานที่อยู่ติดกันอาจมีการเปลี่ยนข้ามระดับได้ แต่เมื่ออิเล็กตรอนรับพลังงานแล้วจะขึ้นไปอยู่ระหว่างระดับพลังงานไม่ได้ จะต้องขึ้นไปอยู่ในระดับใดระดับหนึ่งเสมอ
3. ผลต่างของพลังงานระหว่างระดับพลังงานต่ำจะมีค่ามากกว่าผลต่างของพลังงานระหว่างระดับพลังงานที่สูงขึ้นไป
สมบัติของธาตุตามตารางธาตุ
ขนาดอะตอม
ขนาดของอะตอมหาขอบเขตจำกัดได้ยาก เนื่องจากอิเล็กตรอนโคจรรอบนิวเคลียสตลอดเวลาด้วยความเร็วสูงและไม่มีตำแหน่งที่แน่นอน
ดังนั้นขนาดอะตอมที่แน่นอนวัดกันไม่ได้ ในทางปฏิบัติจึงหาขนาดอะตอมด้วยรัศมีอะตอม ซึ่งมีค่าเท่ากับครึ่งหนึ่งของระยะระหว่างนิวเคลียสของอะตอมคู่ที่สร้างพันธะต่อกันหรือที่อยู่ชิดกัน

แสดงรัศมีอะตอม (พิโกเมตร) ของธาตุตามหมู่และตามคาบ
 ขนาดอะตอมใหญ่ขึ้นจากบนลงล่าง เพราะธาตุในหมู่เดียวกัน เมื่อเลขอะตอมเพิ่มขึ้นเป็นผลให้จำนวนโปรตอนในนิวเคลียสและ
ขนาดอะตอมใหญ่ขึ้นจากบนลงล่าง เพราะธาตุในหมู่เดียวกัน เมื่อเลขอะตอมเพิ่มขึ้นเป็นผลให้จำนวนโปรตอนในนิวเคลียสและ
จำนวนระดับพลังงานที่มีอิเล็กตรอนอยู่เพิ่มขึ้นด้วย การที่เวเลนซ์อิเล็กตรอนอยู่ห่างนิวเคลียสมากขึ้น เป็นผลให้ธาตุในหมู่เดียวกันมีขนาดอะตอมใหญ่ขึ้นตามเลขอะตอม แสดงว่าการเพิ่มจำนวนระดับพลังงานมีผลมากกว่า การเพิ่มจำนวนโปรตอนในนิวเคลียส
แนวโน้มขนาดอะตอมในคาบเดียวกันจากซ้ายไปขวา

ขนาดอะตอมของธาตุที่อยู่ในคาบเดียวกันจากซ้ายไปขวา เมื่อเลขอะตอมเพิ่มขึ้น(เลขอะตอมแสดงถึงจำนวนโปรตอนที่นิวเคลียส) เพราะธาตุในคาบเดียวกัน
มีเวเลนซ์อิเล็กตรอนอยู่ในระดับพลังงานเดียวกัน แต่มีจำนวนโปรตอนในนิวเคลียส
แตกต่างกัน ธาตุที่มีโปรตอนมากจะดึงดูดเวเลนซ์อิเล็กตรอนได้แรงมากกว่าธาตุที่มีโปรตอนน้อย เวเลนซ์อิเล็กตรอนจึงเข้าใกล้นิวเคลียสได้มากกว่า ทำให้อะตอมมีขนาดเล็กลง
อิเล็กโทรเนกาติวีตี
อิเล็กโทรเนกาติวิตี คือ ค่าความสามารถในการดึงอิเล็กตรอนของอะตอมที่รวมกันเป็น สารประกอบ ธาตุที่มีค่าอิเล็กโตรเนกาติวีตีสูงจะดึงอิเล็กตรอนดีกว่าธาตุที่มีค่าอิเล็กโตรเนกาติวีตีต่ำกว่า พอลิง นักเคมีชาวอเมริกา เป็นคนแรกที่ได้กำหนดค่าอิเล็กโตรเนกาติวีตีของธาตุขึ้น แต่พอลิงไม่ได้คำนวณหาค่าอิเล็กโตรเนกาติวีตีของก๊าซเฉื่อยไว้ เพราะก๊าซเฉื่อยทำปฏิกิริยาเกิดเป็นสารประกอบได้ยาก
พลังงานไอออไนเซชั่น
ไอออไนเซชัน (Ionization Enery ใช้ตัวย่อว่า IE) หมายถึง ปริมาณพลังงานน้อยที่สุดที่ทำให้เล็กตรอนหลุดออก
จากอะตอมในภาวะก๊าซ โดยปกติอะตอมเป็นกลางทางไฟฟ้า เพราะมีจำนวนอิเล็กตรอนเท่ากับโปรตอน
ถ้าดึงอิเล็กตรอนออกจาก อะตอมในสภาวะก๊าซทำให้อะตอมมีจำนวนโปรตอนมากกว่าอิเล็กตรอน
อะตอมจึงแสดงประจุบวกขึ้นมา เรียกว่า ไอออนบวก ดังสมการ
M(g) -----> M+(g) + e-
อะตอมของธาตุส่วนใหญ่จะมีอิเล็กตรอนหลายอิเล็กตรอน ถ้าใช้พลังงานดึงอิเล็กตรอนตัวแรกที่อยุ่นอกสุดหลุด
ออกจากอะตอมเรียกว่าพลังงานไอออไนเซชันลำดับที่ 1 (IE1) และเรียกพลังงานที่ใช้ดึงอิเล็กตรอนตัวที่ 2 ออกจาก
อะตอมนี้ว่า พลังงานไอออไนเซชันลำดับที่ 2 (IE2)
สัมพรรคภาพอิเล็กตรอน
สัมพรรคภาพอิเล็กตรอนเขียนย่อเป็น EA คือ ปริมาณพลังงานที่ คายออกมา
เมื่ออะตอมในภาวะก๊าซรับอิเล็กตรอนแล้วกลายเป็นไอออนลบ เช่น
17Cl(g) + e- -----> Cl-(g) EA = -348 kJ/mol
11Na(g) + e- ---> Na-(g) EA = -53 kJ/mol
แสดงว่า Cl รับอิเล็กตรอนได้ง่ายกว่า Na เพราะคายพลังงานออกมาได้มากกว่า
สรุป ธาตุที่มีค่าอิเล็กตรอนฟินิตีสูงรับอิเล็กตรอนได้ง่ายเกิดเป็นไอออนลบได้ง่าย ส่วนธาตุโลหะมีค่าสัมพรรคภาพอิเล็กตรอนลบน้อย ๆ ถึงค่าบวกน้อย ๆ แนวโน้มจะเสียอิเล็กตรอนสูงมาก
ขนาดอะตอม
ขนาดของอะตอมหาขอบเขตจำกัดได้ยาก เนื่องจากอิเล็กตรอนโคจรรอบนิวเคลียสตลอดเวลาด้วยความเร็วสูงและไม่มีตำแหน่งที่แน่นอน
ดังนั้นขนาดอะตอมที่แน่นอนวัดกันไม่ได้ ในทางปฏิบัติจึงหาขนาดอะตอมด้วยรัศมีอะตอม ซึ่งมีค่าเท่ากับครึ่งหนึ่งของระยะระหว่างนิวเคลียสของอะตอมคู่ที่สร้างพันธะต่อกันหรือที่อยู่ชิดกัน

แสดงรัศมีอะตอม (พิโกเมตร) ของธาตุตามหมู่และตามคาบ
 ขนาดอะตอมใหญ่ขึ้นจากบนลงล่าง เพราะธาตุในหมู่เดียวกัน เมื่อเลขอะตอมเพิ่มขึ้นเป็นผลให้จำนวนโปรตอนในนิวเคลียสและ
ขนาดอะตอมใหญ่ขึ้นจากบนลงล่าง เพราะธาตุในหมู่เดียวกัน เมื่อเลขอะตอมเพิ่มขึ้นเป็นผลให้จำนวนโปรตอนในนิวเคลียสและจำนวนระดับพลังงานที่มีอิเล็กตรอนอยู่เพิ่มขึ้นด้วย การที่เวเลนซ์อิเล็กตรอนอยู่ห่างนิวเคลียสมากขึ้น เป็นผลให้ธาตุในหมู่เดียวกันมีขนาดอะตอมใหญ่ขึ้นตามเลขอะตอม แสดงว่าการเพิ่มจำนวนระดับพลังงานมีผลมากกว่า การเพิ่มจำนวนโปรตอนในนิวเคลียส
แนวโน้มขนาดอะตอมในคาบเดียวกันจากซ้ายไปขวา

ขนาดอะตอมของธาตุที่อยู่ในคาบเดียวกันจากซ้ายไปขวา เมื่อเลขอะตอมเพิ่มขึ้น(เลขอะตอมแสดงถึงจำนวนโปรตอนที่นิวเคลียส) เพราะธาตุในคาบเดียวกัน
มีเวเลนซ์อิเล็กตรอนอยู่ในระดับพลังงานเดียวกัน แต่มีจำนวนโปรตอนในนิวเคลียส
แตกต่างกัน ธาตุที่มีโปรตอนมากจะดึงดูดเวเลนซ์อิเล็กตรอนได้แรงมากกว่าธาตุที่มีโปรตอนน้อย เวเลนซ์อิเล็กตรอนจึงเข้าใกล้นิวเคลียสได้มากกว่า ทำให้อะตอมมีขนาดเล็กลง
อิเล็กโทรเนกาติวีตี
อิเล็กโทรเนกาติวิตี คือ ค่าความสามารถในการดึงอิเล็กตรอนของอะตอมที่รวมกันเป็น สารประกอบ ธาตุที่มีค่าอิเล็กโตรเนกาติวีตีสูงจะดึงอิเล็กตรอนดีกว่าธาตุที่มีค่าอิเล็กโตรเนกาติวีตีต่ำกว่า พอลิง นักเคมีชาวอเมริกา เป็นคนแรกที่ได้กำหนดค่าอิเล็กโตรเนกาติวีตีของธาตุขึ้น แต่พอลิงไม่ได้คำนวณหาค่าอิเล็กโตรเนกาติวีตีของก๊าซเฉื่อยไว้ เพราะก๊าซเฉื่อยทำปฏิกิริยาเกิดเป็นสารประกอบได้ยาก
พลังงานไอออไนเซชั่น
ไอออไนเซชัน (Ionization Enery ใช้ตัวย่อว่า IE) หมายถึง ปริมาณพลังงานน้อยที่สุดที่ทำให้เล็กตรอนหลุดออก
จากอะตอมในภาวะก๊าซ โดยปกติอะตอมเป็นกลางทางไฟฟ้า เพราะมีจำนวนอิเล็กตรอนเท่ากับโปรตอน
ถ้าดึงอิเล็กตรอนออกจาก อะตอมในสภาวะก๊าซทำให้อะตอมมีจำนวนโปรตอนมากกว่าอิเล็กตรอน
อะตอมจึงแสดงประจุบวกขึ้นมา เรียกว่า ไอออนบวก ดังสมการ
M(g) -----> M+(g) + e-
อะตอมของธาตุส่วนใหญ่จะมีอิเล็กตรอนหลายอิเล็กตรอน ถ้าใช้พลังงานดึงอิเล็กตรอนตัวแรกที่อยุ่นอกสุดหลุด
ออกจากอะตอมเรียกว่าพลังงานไอออไนเซชันลำดับที่ 1 (IE1) และเรียกพลังงานที่ใช้ดึงอิเล็กตรอนตัวที่ 2 ออกจาก
อะตอมนี้ว่า พลังงานไอออไนเซชันลำดับที่ 2 (IE2)
สัมพรรคภาพอิเล็กตรอน
สัมพรรคภาพอิเล็กตรอนเขียนย่อเป็น EA คือ ปริมาณพลังงานที่ คายออกมา
เมื่ออะตอมในภาวะก๊าซรับอิเล็กตรอนแล้วกลายเป็นไอออนลบ เช่น
17Cl(g) + e- -----> Cl-(g) EA = -348 kJ/mol
11Na(g) + e- ---> Na-(g) EA = -53 kJ/mol
แสดงว่า Cl รับอิเล็กตรอนได้ง่ายกว่า Na เพราะคายพลังงานออกมาได้มากกว่า
สรุป ธาตุที่มีค่าอิเล็กตรอนฟินิตีสูงรับอิเล็กตรอนได้ง่ายเกิดเป็นไอออนลบได้ง่าย ส่วนธาตุโลหะมีค่าสัมพรรคภาพอิเล็กตรอนลบน้อย ๆ ถึงค่าบวกน้อย ๆ แนวโน้มจะเสียอิเล็กตรอนสูงมาก
ความหมายของพันธะเคมี
ความหมายและการเกิดพันธะเคมี

พันธะเคมีคือ แรงยึดเหนี่ยวที่อยู่ระหว่างอะตอมซึ่งทำให้อะตอมต่าง ๆ เข้ามาอยู่รวมกันเป็นโมเลกุลได้ การสร้างพันธะเคมีของอะตอมเกิดขึ้นได้ เนื่องจากอะตอมต้องการจะปรับตัวให้ตนเองมีเวเลนซ์อิเล็กตรอนครบ 8 หรือให้ใกล้เคียงกับการครบ 8 ให้มากที่สุด (ตามกฎออกเตต) ดังนั้นจึงต้องอาศัยอะตอมอื่น ๆ มาเป็นตัวช่วยให้อิเล็กตรอนเข้ามาเสริม หรือเป็นตัวรับเอาอิเล็กตรอนออกไป และจากความพยายามในการปรับตัวของอะตอมเช่นนี้เองที่ทำให้อะตอมมีการสร้างพันธะเคมีกับอะตอมอื่น ๆ
เรามาลองทำความเข้าใจในการเกิดพันธะเคมีของอะตอม จากตัวอย่างการเกิดพันธะเคมีในโมเลกุลแก๊สไฮโดรเจน (H2) ดังต่อไปนี้
1. เมื่ออะตอมของธาตุไฮโดรเจน (H) อยู่อย่างเป็นอิสระ อะตอมของธาตุไฮโดรเจนจะมีเวเลนซ์อิเล็กตรอนอยู่เพียง 1 อนุภาค ซึ่งเป็นจำนวนอิเล็กตรอนที่ยังไม่ครบ 2 ตามกฎออกเตต (สำหรับธาตุไฮโดรเจนต้องมี 2 อนุภาค จึงครบตามกฎของออกเตต) ดังนั้นอะตอมของธาตุไฮโดรเจนจึงต้องเข้าหาอะตอมอื่น ๆ เพื่อที่จะได้รับอิเล็กตรอนเข้ามาเพิ่มให้ครบ 2 อนุภาค
2. เมื่ออะตอมของธาตุไฮโดรเจน 2 อะตอม เคลื่อนที่เข้ามาอยู่ใกล้กันในระยะพอเหมาะ อิเล็กตรอนของอะตอมไฮโดรเจนแต่ละอะตอมจะถูกนิวเคลียสของอะตอมอีกอะตอมหนึ่งพยายามดึงดูดเอาไว้ ทำให้อิเล็กตรอนเคลื่อนที่ได้ช้าลง และเมื่ออิเล็กตรอนเคลื่อนที่ได้ช้าลง จะทำให้ระดับพลังงานภายในโมเลกุลของอะตอมไฮโดรเจนลดต่ำลง อะตอมของไฮโดรเจนจึงมีความเสถียรมากขึ้น และแรงดึงดูดที่เกิดจากอะตอมของไฮโดรเจนดึงดูดอิเล็กตรอนนี้เอง ที่ทำให้อะตอของธาตุสามารถยึดเหนี่ยวกันได้
3. ระยะห่างระหว่างอะตอมไฮโดรเจนจะมีค่าคงที่ใกล้เคียงกันเสมอ เนื่องจากถ้าอะตอมของไฮโดรเจนทั้ง 2 เข้าใกล้กันมากเกินไป จะทำให้เกิดแรงผลักระหว่างนิวเคลียสของทั้งสองอะตอมมากเกินไป และถ้าหากอะตอมอยู่ห่างกันมากกว่านี้ แรงดึงดูดที่อะตอมมีต่อกันก็จะน้อยเกินไป จนไม่สามารถดึงดูดอิเล็กตรอนของอีกอะตอมได้
การสร้างพันธะเคมีของอะตอมสามารถเกิดขึ้นได้ในหลายลักษณะ โดยในแต่ละลักษณะจะมีสมบัติและความแข็งแรงของพันธะเคมีชนิดใดต่อกันนั้น จะขึ้นอยู่กับจำนวนเวเลนซ์อิเล็กตรอนและสมบัติของแต่ละอะตอมที่เข้ามาสร้างพันธะเคมีต่อกันเป็นสำคัญ โดยเราสามารถจำแนกพันธะเคมีได้เป็น 3 ชนิด คือ พันธะโคเวเลนต์ พันธะไอออนิกH และพันธะโลหะ

พันธะโลหะ
พันธะโลหะ (Metallic bond) หมายถึง แรงยึดเหนี่ยวที่ทำให้อะตอมของโลหะ อยู่ด้วยกันในก้อนของโลหะ โดยมีการใช้เวเลนต์อิเล็กตรอนร่วมกันของอะตอมของโลหะ โดยที่เวเลนต์อิเล็กตรอนนี้ไม่ได้เป็นของอะตอมหนึ่งอะตอมใดโดยเฉพาะ เนื่องจากมีการเคลื่อนที่ตลอดเวลา ทุกๆอะตอมของโลหะจะอยู่ติดกันกับอะตอมอื่นๆ ต่อเนื่องกันไม่มีที่สิ้นสุด จึงทำให้โลหะไม่มีสูตรโมเลกุล ที่เขียนกันเป็นสูตรอย่างง่าย หรือสัญลักษณ์ของธาตุนั้นเองสมบัติทั่วไปของโลหะ
พันธะโคเวเลนต์

ถ้าอะตอมคู่ร่วมพันธะใช้อิเล็กตรอนร่วมกัน 2 คู่จะเกิดเป็นพันธะโคเวเลนต์ที่เรียกว่า พันธะคู่ เช่น ในโมเลกุลของออกซิเจนถ้าอะตอมคู่ร่วมพันธะใช้อิเล็กตรอนร่วมกัน 3 คู่จะเกิดเป็นพันธะโคเวเลนต์ที่เรียกว่า พันธะสาม เช่น ในโมเลกุลของไฮโดรเจน
จากการศึกษาสารโคเวเลนซ์จะพบว่า ธาตุที่จะสร้างพันธะโคเวเลนต์ส่วนมากเป็นธาตุอโลหะกับอโลหะ ทั้งนี้เนื่องจากโลหะมีพลังงานไอออไนเซชันค่อนข้างสูง จึงเสียอิเล็กตรอนได้ยาก เมื่ออโลหะรวมกันเป็นโมเลกุลจึงไม่มีอะตอมใดเสียอิเล็กตรอน มีแต่ใช้อิเล็กตรอนร่วมกันเกิดเป็นพันธะโคเวเลนต์ อย่างไรก็ตามโลหะบางชนิดก็สามารถเกิดพันธะโคเวเลนต์กับอโลหะได้ เช่น Be เกิดเป็นสารโคเวเลนซ์คือ BeCl2เป็นต้นชนิดของพันธะโคเวเลนต์
อะตอมที่เกิดพันธะ นักเคมีนิยมใช้การเขียนสัญลักษณ์แบบจุดของลิวอิส โดยประกอบด้วยสัญลักษณ์แทนนิวเคลียสกับอิเล็กตรอนในชั้นถัดจากเวเลนซ์อิเล็กตรอนเข้าไป และจุดรอบสัญลักษณ์แทนจำนวนเวเลนซ์อิเล็กตรอนของธาตุนั้น ๆ
ชนิดของพันธะโคเวเลนต์
พิจารณาจากจำนวนอิเล็กตรอนที่ใช้ร่วมกันของอะตอมคู่ร่วมพันธะ ดังนี้
ก. พันธะเดี่ยว เป็นพันธะโคเวเลนต์ที่เกิดจากอะตอมคู่สร้างพันธะทั้งสองใช้อิเล็กตรอนร่วมกัน1 คู่ ใช้เส้น ( - ) แทนพันธะเดี่ยว
ข. พันธะคู่เป็นพันธะโคเวเลนต์ที่เกิดจากอะตอมคู่สร้างพันธะทั้งสองใช้อิเล็กตรอนร่วมกัน 2 คู่ ใช้เส้น 2 เส้น (= ) แทน 1 พันธะคู่ เช่น พันธะระหว่าง O ใน O2, O กับ C ใน CO2, C กับ H ใน C2H4
ค. พันธะสามเป็นพันธะโคเวเลนต์ที่เกิดจากอะตอมคู่สร้างพันธะทั้งสองใช้อิเล็กตรอนร่วมกัน 3 คู่ ใช้เส้น 3 เส้น ( = ) แทน 1 พันธะสาม เช่น พันธะระหว่าง N กับ N ใน N2 , N กับ C ใน HCN
ข. พันธะคู่เป็นพันธะโคเวเลนต์ที่เกิดจากอะตอมคู่สร้างพันธะทั้งสองใช้อิเล็กตรอนร่วมกัน 2 คู่ ใช้เส้น 2 เส้น (= ) แทน 1 พันธะคู่ เช่น พันธะระหว่าง O ใน O2, O กับ C ใน CO2, C กับ H ใน C2H4
ค. พันธะสามเป็นพันธะโคเวเลนต์ที่เกิดจากอะตอมคู่สร้างพันธะทั้งสองใช้อิเล็กตรอนร่วมกัน 3 คู่ ใช้เส้น 3 เส้น ( = ) แทน 1 พันธะสาม เช่น พันธะระหว่าง N กับ N ใน N2 , N กับ C ใน HCN
สภาพขั้วโมเลกุลโคเวเลนต์
สภาพมีขั้วของโมเลกุลในพันธะโคเวเลนต์ อิเล็กตรอนคู่ร่วมพันธะจะเคลื่อนที่อยู่ระหว่างอะตอมทั้งสองที่สร้างพันธะกัน ถ้าพบว่าอิเล็กตรอนคู่ร่วมพันธะเคลื่อนที่อยู่ตรงกลางระหว่างอะตอมพอดี แสดงว่าอะตอมคู่นั้นมีความสามารถในการดึงดูดอิเล็กตรอนคู่ร่วมพันธะเท่ากัน แต่ถ้าพบว่าอิเล็กตรอนคู่ร่วมพันธะเคลื่อนที่อยู่ใกล้อะตอมใดอะตอมหนึ่งมากกว่าอีกอะตอมหนึ่ง แสดงว่าอะตอมคู่นั้น มีความสามารถในการดึงดูดอิเล็กตรอนคู่ร่วมพันธะไม่เท่ากัน ดังภาพ


อิเล็กตรอนถ่ายเทจากอะตอมหนึ่งไปสู่อีกอะตอมหนึ่ง
ค่าที่บอกให้ทราบถึงความสามารถในการดึงดูดอิเล็กตรอนของธาตุที่สร้างพันธะกันเป็นสารประกอบเรียกว่าอิเล็กโทรเนกาติวิตี (Electronegativity) ค่าอิเล็กโทรเนกาติวิตี จะมีค่ามากหรือน้อยขึ้นอยู่กับจำนวนประจุในนิวเคลียส และระยะระหว่างเวเลนต์อิเล็กตรอนกับนิวเคลียสธาตุที่มีจำนวนประจุในนิวเคลียสมาก แต่มีระยะระหว่างเวเลนต์อิเล็กตรอนกับนิวเคลียสห่างกันน้อย จะมีค่าค่าอิเล็กโทรเนกาติวิตีสูงกว่าธาตุที่มีมีจำนวนประจุในนิวเคลียสน้อย แต่มีระยะระหว่างเวเลนต์อิเล็กตรอนกับนิวเคลียสห่างกันมาก
ค่าอิเล็กโทรเนกาติวิตี (EN)

ค่าอิเล็กโทรเนกาติวิตีนำไปใช้อธิบายสมบัติบางประการของสารได้ เช่น ขั้วของพันธะโคเวเลนต์
- ถ้าพันธะโคเวเลนต์เกิดจากอะตอมที่มีค่าค่าอิเล็กโทรเนกาติวิตีเท่ากัน เช่นพันธะในโมเลกุลของ H2, O2, N2, F2, Br2, I2, P4อิเล็กตรอนคู่ร่วมพันธะจะอยู่ตรงกลางระหว่างอะตอมทั้งสองเป็นส่วนใหญ่ หรืออาจกล่าวได้ว่าอิเล็กตรอนคู่ร่วมพันธะจะถูกนิวเคลียสของอะตอมทั้งสองดึงดูดด้วบแรงเท่าๆกัน เราเรียกพันธะโคเวเลนต์ที่เกิดขึ้นในลักษณะนี้ว่าพันธะโคเวเลนต์ไม่มีขั้วสรุป พันธะที่เกิดจากอะตอมของธาตุชนิดเดียวกันเป็นพันธะไม่มีขัว
- ถ้าพันธะโคเวเลนต์เกิดจากอะตอมที่มีค่าอิเล็กโทรเนกาติวิตีต่างกัน อะตอมที่มีค่าอิเล็กโทรเนกาติวิตีมากกว่า จะดึงอิเล็กตรอนคู่ร่วมพันธะเข้ามาใกล้ตัวมันเอง อะตอมนี้จะแสดงอำนาจไฟฟ้าเป็นลบ และอะตอมที่มีค่าอิเล็กโทรเนกาติวิตีน้อยกว่าจะถูกดึงอิเล็กตรอนคู่ร่วมพันธะไป อะตอมนี้จะแสดงอำนาจไฟฟ้าบวก เราเรียกพันธะโคเวเลนต์ชนิดนี้ว่าพันธะโคเวเลนต์มีขั้ว
การแสดงขั้วของพันธะโคเวเลนต์ ใช้สัญลักษณ์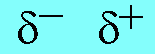
และความแรงของขั้วของพันธะขึ้นกับผลต่างของค่าอิเล็กโทรเนกาติวิตีของอะตอมคู่สร้างพันธะ โดยถ้าค่าอิเล็กโทรเนกาติวิตีแตกต่างกันมากกว่า สภาพขั้วจะแรงกว่า เช่น H – F มีสภาพขั้วแรงกว่า H – Cl
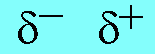
และความแรงของขั้วของพันธะขึ้นกับผลต่างของค่าอิเล็กโทรเนกาติวิตีของอะตอมคู่สร้างพันธะ โดยถ้าค่าอิเล็กโทรเนกาติวิตีแตกต่างกันมากกว่า สภาพขั้วจะแรงกว่า เช่น H – F มีสภาพขั้วแรงกว่า H – Cl
สรุปพันธะที่เกิดจากอะตอมต่างชนิดกันเป็นพันธะมีขั้วขั้วของโมเลกุลวิธีพิจารณาว่าโมเลกุลใดมีขั้วหรือไม่มีขั้วมีหลักดังนี้
1.โมเลกุลใดที่มีแต่พันธะที่ไม่มีขั้วทั้งสิ้น จัดเป็นโมเลกุลที่ไม่มีขั้ว เช่น H2, O2, N2, F2, Br2, I2, P42.โมเลกุลใดที่มีพันธะมีขั้ว โมเลกุลนั้นอาจมีขั้วหรือไม่มีขั้วก็ได้ ขึ้นกับการเขียนเวกเตอร์ แล้วดูการหักล้างกันของทิศทางของขั้วของพันธะรอบอะตอมกลาง ถ้าหักล้างกันหมดโมเลกุลนั้นจะไม่มีขั้ว แต่ถ้าหักล้างกันไม่หมดโมเลกุลนั้นจะมีขั้วโดยทิศทางของขั้วลบของโมเลกุลชี้ไปทางทิศทางของผลลัพธ์ เช่นและความแรงของขั้วของพันธะขึ้นกับผลต่างของค่าอิเล็กโทรเนกาติวิตีของอะตอมคู่สร้างพันธะ โดยถ้าค่าอิเล็กโทรเนกาติวิตีแตกต่างกันมากกว่า สภาพขั้วจะแรงกว่า เช่น H – F มีสภาพขั้วแรงกว่า H – Clสรุปพันธะที่เกิดจากอะตอมต่างชนิดกันเป็นพันธะมีขั้วขั้วของโมเลกุลวิธีพิจารณาว่าโมเลกุลใดมีขั้วหรือไม่มีขั้วมีหลักดังนี้1.โมเลกุลใดที่มีแต่พันธะที่ไม่มีขั้วทั้งสิ้น จัดเป็นโมเลกุลที่ไม่มีขั้ว เช่น H2, O2, N2, F2, Br2, I2, P4
2.โมเลกุลใดที่มีพันธะมีขั้ว โมเลกุลนั้นอาจมีขั้วหรือไม่มีขั้วก็ได้ ขึ้นกับการเขียนเวกเตอร์ แล้วดูการหักล้างกันของทิศทางของขั้วของพันธะรอบอะตอมกลาง ถ้าหักล้างกันหมดโมเลกุลนั้นจะไม่มีขั้ว แต่ถ้าหักล้างกันไม่หมดโมเลกุลนั้นจะมีขั้วโดยทิศทางของขั้วลบของโมเลกุลชี้ไปทางทิศทางของผลลัพธ์ เช่นและความแรงของขั้วของพันธะขึ้นกับผลต่างของค่าอิเล็กโทรเนกาติวิตีของอะตอมคู่สร้างพันธะ โดยถ้าค่าอิเล็กโทรเนกาติวิตีแตกต่างกันมากกว่า สภาพขั้วจะแรงกว่า เช่น H – F มีสภาพขั้วแรงกว่า H – Clสรุปพันธะที่เกิดจากอะตอมต่างชนิดกันเป็นพันธะมีขั้ว
พันธะไฮโดรเจน
พันธะไฮโดรเจนคือ พันธะที่เกิดขึ้นอันเนื่องมาจากแรงดึงดูดระหว่างโมเลกุลสองโมเลกุล ซึ่งแต่ละโมเลกุลนั้นประกอบด้วยอะตอมของไฮโดรเจนสร้างพันธะโคเวเลนต์กับอะตอมของธาตุที่มีค่าอิเล็กโทรเนกาติวิตี (en) สูงมากๆ เช่น F, O และ N ซึ่งมีค่าอิเล็กโทรเนกาติวิตีประมาณ 3.98, 3.44 และ 3.04 ตามลำดับ เช่น การเกิดพันธะไฮโดรเจนระหว่างอะตอม ไฮโดรเจน และ ออกซิเจน แสดงได้ดังรูป
เปรียบเทียบโครงสร้างของน้ำและน้ำแข็ง
ในกรณีของน้ำโมเลกุลแต่ละโมเลกุลของน้ำอาจเกิดพันธะไฮโดรเจนกับโมเลกุลของน้ำข้างเคียงอีกสี่อะตอม (ดังรูป) โครงสร้างของน้ำที่เป็นของเหลว เกิดจากโมเลกุลของน้ำหลายๆโมเลกุลยึดกันด้วยพันธะไฮโดรเจน แต่ว่ายังไม่ค่อยเป็นระเบียบนักเนื่องจากโครงสร้างของน้ำมีส่วนหนึ่งดึงดูดกันอยู่ด้วยแรงขั้วคู่-ขั้วคู่ และ การสร้างและสลายพันธะไฮโดรเจนตลอดเวลา โครงสร้างของน้ำ (ของเหลว) แสดงได้ดังรูป
 |  |
ในกรณีของน้ำแข็งโมเลกุลของน้ำแต่ละโมเลกุลสร้างพันธะไฮโดรเจนกับโมเลกุลอื่นๆอีก 4 โมเลกุลเช่นเดียวกัน แต่มีความเป็นระเบียบมากกว่า โดยระยะห่างระหว่างออกซิเจนของโมเลกุลของตัวมันเองกับโมเลกุลใกล้เคียงมีค่าประมาณ 2.76 อังสตรอม (Ao) ผลึกของน้ำแข็งมีได้หลายรูป แต่รูปที่พบในธรรมชาติ คือ hexagonal


 www.ill.fr/dif/ 3D-gallery.html
www.ill.fr/dif/ 3D-gallery.html
เพื่อความเข้าใจมากขึ้นขออธิบายพันธะไฮโดรเจนผ่านกระบวนการการเกิดเป็นน้ำแข็งของน้ำ ซึ่งจะช่วยให้แยกแยะระหว่างพันธะโคเวเลนต์กับพันธะไฮโดรเจนได้เป็นอย่างดี
น้ำ 1 โมเลกุลประกอบด้วย

ออกซิเจน 1 อะตอมออกซิเจนซึ่งมีเวเลนซ์อิเล็กตรอนเท่ากับ 6 ดังนั้นเมื่อใช้อิเล็กตรอนไป 2 ตัวเพื่อเกิดพันธะโคเวเลนต์กับ H สองอะตอม (อะตอมละ 1 อิเล็กตรอน) จึงเหลือ 4 อิเล็กตรอนหรือมีอิเล็กตรอนคู่โดดเดี่ยว 2 คู่ ดังรูป

การเกิดพันธะไฮโดรเจนในกรณีนี้เกิดจากแรงดึงดูดระหว่างอะตอมของ H ซึ่งมีประจุบวก กับอิเล็กตรอนคู่โดดเดี่ยวซึ่งมีประจุลบ ดังรูป
ดังนั้นน้ำแข็งจึงเกิดจากโมเลกุลของน้ำหลายๆโมเลกุลเชื่อมกัน หรืออาจกล่าวได้ว่าอะตอมของ O เชื่อมกันโดยอาศัยพันธะโคเวเลนต์และพันธะไฮโดรเจนร่วมกัน โดย 1 อะตอมของออกซิเจนจะเชื่อมกับอีก 4 อะตอมของออกซิเจน ดังรูป
เกิดเป็นผลึกของน้ำแข็งมีลักษณะโครงสร้างคล้ายเพชร ดังรูป
 | |
 |
| เพื่อที่จะสามารถมองและเข้าใจเกี่ยวกับพันธะไฮโดรเจนได้กว้างขึ้น ให้นักเรียนลองพิจารณาพันธะไฮโดรเจนใน DNA (deoxyribonucleic acid) เป็นที่รู้กันว่าโครงสร้างของ DNA ประกอบด้วยสามส่วนที่สำคัญ คือ หมู่ฟอสเฟต น้ำตาล และ เบส ซึ่งเบส ที่พบใน DNA มี 4 ชนิด คือ Adenine(A), Thymine(T), Guanine(G), Cytosine(C)ต่อกันเป็นสายยาวแบบเกลียวคู่ (double helix) โดยเบสที่เข้าคู่จะมีความจำเพาะ นั่นคือโดยทั่วไปแล้ว เบส A จะเข้าคู่กับ T และ C จะเข้าคู่กับ Gทำไมถึงเป็นเช่นนั้นหละ ? ถ้าอยากรู้ลองพิจารณาจากรูปครับ ที่มา:1.http://www.scimath.org/lesson-chemistry/item/7121-atomic-model 2.http://www.scimath.org/lesson-chemistry/item/7097-2017-06-04-03-08-02 |



